基本信息
- 项目名称:
- 六氟乙烷的热分解特性
- 来源:
- 第十一届“挑战杯”国赛作品
- 小类:
- 能源化工
- 大类:
- 自然科学类学术论文
- 简介:
- 采用管式电阻炉对六氟乙烷进行热分解实验,研究了停留时间、反应温度、六氟乙烷初始浓度对六氟乙烷热分解率的影响。根据Arrhenius方程计算,获得六氟乙烷在950-1100℃,热分解反应的活化能(Ea)和频率因子(A)。
- 详细介绍:
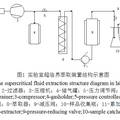
- 氟利昂由于其独特的理化性质曾被视为理想的制冷剂,但由于其具有强温室化能力,并且是破坏臭氧层的元凶,而遭到各国的联合限用、禁用。为了保持社会经济的可持续发展,合理使用和排放氟利昂显得尤为重要。 本作品主要是关于采用管式炉热分解法研究六氟乙烷热分解的特性。逐个讨论了热分解温度、反应停留时间、六氟乙烷的初始浓度对六氟乙烷的热分解率的影响。本试验分解温度为950℃-1100℃,停留时间约为2-5s,六氟乙烷的初始浓度范围定为0.5-2%(体积分数)。六氟乙烷与空气预混合后通入管式炉内进行热分解,反应后的产物经冷却净化后由傅立叶变换红外光谱仪(FT-IR)进行检测,获得分解后尾气中残余六氟乙烷的浓度。 实验结果表明: C2F6初始浓度越低、温度越高、反应时间越长,C2F6分解率就越高。并通过化学反应速率的定义式及实验所得相关数据,计算出不同温度下的反应速率常数;再根据Arrhenius方程,结合不同温度下反应速率常数,获得六氟乙烷在950~1100 ℃热分解反应(不含催化剂)的活化能Ea为313.2 kJ・mol-1,频率因子A为8.8×1011s-1。本实验为氟利昂的工业化处理装置的小型化提供了一定的理论和实践基础。
作品专业信息
撰写目的和基本思路
- 国内外学者对于氟利昂的分解进行了大量的研究,并提出了多种分解氟利昂气体的方法,有的分解方法还可以取得较好的分解效果,但是关于氟利昂热分解特性的研究还鲜有报道。据此,本研究通过采用管式炉热分解的方法,对六氟乙烷(C2F6)的热分解进行实验研究以揭示六氟乙烷热分解机理,并获得六氟乙烷热分解的动力学参数。本实验主要研究了C2F6初始浓度、反应温度、反应停留时间对C2F6热分解率的影响。
科学性、先进性及独特之处
- 1.作品的科学性、先进性:采用控制影响因素法研究不同因素(试验分解温度、停留时间、c2F6的初始浓度)对c2F6热分解率的影响。反应后的产物由傅立叶变换红外光谱仪进行检测.计算获得c2F6热分解的反应活化能及指前因子。 2.作品的独特性:采用管式炉热分解的方法研究了c2F6的热分解性质,获得了其分解的动力学参数,为氟利昂分解装置的小型化及推广提供理论和实践基础
应用价值和现实意义
- 全球气候变暖已经是科学界不争事实,而引起全球变暖的主要原因是温室气体排放的增加。本研究通过大量的实验研究揭示了氟利昂分解机理,获得了氟利昂分解的动力学参数,为氟利昂热分解装置的小型化和进一步推广提供数据支持和理论基础。
学术论文摘要
- 采用管式炉研究了950-1100 ℃温度区间C2F6分解特性,并研究了C2F6初始浓度、反应温度、停留时间对C2F6分解率的影响。实验结果表明: C2F6初始浓度越低、温度越高、反应时间越长,C2F6分解率就越高。同时,热解反应的反应级数应该介于0和1之间。在温度为1100 ℃,C2F6初始浓度为223.21μmol/L.停留时间为2 s时,C2F6分解率高达90%。根据Arrhenius方程计算,在950-1100 ℃, C2F6热分解反应的活化能(Ea)为313.2 KJ/mol,频率因子(A)为8.8×1011 s-1。
获奖情况
- 《高等学校化学学报》 2009, 30(1):125-128; 获湖北省第七届“挑战杯”大学生课外学术科技作品竞赛一等奖 2009.5
鉴定结果
- SCI检索报告
参考文献
- 1.常用的氟利昂分解的方法主要有:等离子体法;化学气相沉积法;催化分解法;超声波分解法等。 2.参考文献[1] Urashima K., Kostov K. G.,et al.. IEEE Transactions on Industry Applications,2001, 37(5): 1456—1463 [2] Takayuki W., Taira T.. Thin Solid Films, 2008, 516: 4391—4396 [3] Takaki K., Urashima K. Thin Solid Films, 2006, 506/507: 414—417
同类课题研究水平概述
- 国内外学者针对如何有效、合理地分解C2F6及其它氟利昂气体已做了大量的工作,并取得了一定的成果,如: 1、等离子体分解法:法国的Coulibaly等应用ICP-CaO流化床联用技术进行氟利昂类化合物的消解研究,在高频电感耦合等离子体(ICP)频率为5.4MHz时,CF2Cl2的分解率达到90%,而对化学键能更强的CF4分解率仅为82%。 2、化学气相沉积(CVD)法:日本专家Namose等采用CVD法先对PFC、HFC等进行分解,再用水吸收尾气中的HF和F2等气体,使PFC和HFC的分解率提高,此技术获得美国发明专利。 3、超声波分解法:Nagata等以水为介质,采用超声波法对CFCs、HFCs等进行了分解的研究。结果发现:在氩气氛围下CFC-113的分解速度快于在空气条件下;CFC-113的分解率随液气比的增加而增大。 4、催化分解法:Tajima等研究了在以水为介质的条件下,采用各种固体酸催化剂对CFCs进行催化分解。试验结果发现:在HY,沸石分子筛,H-mordenite, H-ZSM-5, γ-Al2O3和SiO2-TiO2等催化剂存在的情况下,只有40%的CFCs被分解。此外,大量学者研究了加氢脱氯的方法对CFCs的分解和转换。即在催化剂的作用下,氯氟烃与氢反应,生成不含氯原子的氢氟烃(HFCs),HFCs对臭氧层没有破坏作用。 5、燃料燃烧氧化分解法:利用燃料(H2和CH4)、空气或氧气以1200℃的高温将低极性PFCs转化成低分子量且具亲水性的极性或弱极性化合物,如CO2、 HF、COF2等,再以水洗及吸附等方法除去危害性气体,PFCs的去除率可达90%以上,对CF4稍差一些(80-92%)。 以上的研究,对于具体的分解机理讨论的还不太深入,对氟利昂分解的动力学方面的研究还很少。本实验主要是研究氟利昂热分解的动力学。