基本信息
- 项目名称:
- 匹多莫德对映异构体的拆分研究
- 来源:
- 第十二届“挑战杯”省赛作品
- 小类:
- 生命科学
- 大类:
- 自然科学类学术论文
- 简介:
- 匹多莫德,是以RS-构型上市,故需对其手性杂质进行质量控制。本文建立匹多莫德及其对映异构体分离分析的CSP-HPLC法,并结合热力学和分子模拟法,对拆分机理进行探讨。最后以匹多莫德其中一个异构体(4R, 2’R) – PDMD为模板分子进行原位热聚合反应,直接在毛细管柱中合成出具有大孔结构的分子印迹整体柱,实现了(4S, 2’S) – PDMD与(4R, 2’R) – PDMD的拆分。
- 详细介绍:
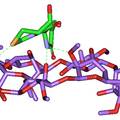
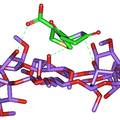
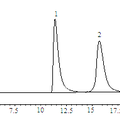
- 一、建立匹多莫德光学异构体检查的手性固定相HPLC法。色谱条件为CHIRALPAK® IA柱 (250 mm×4.6 mm, 5 μm),流动相为甲基叔丁基醚-乙腈-三氟乙酸(35:65:0.2),柱温25 ℃,流速为1.0 mL/min,检测波长为210 nm。在建立的色谱条件下,匹多莫德与其对映异构体可完全分离。本方法简便、准确、专属性强,可用于匹多莫德原料中对映异构体的检测。 二、在CSP-HPLC法分离匹多莫德及其对映异构体的基础上,计算了手性分离过程中的热力学参数,并采用分子对接软件GOLD模拟了IA柱(直链淀粉-三(3,5-二甲基苯基氨基甲酸酯)衍生物)、环糊精类手性添加剂等对匹多莫德对映异构体的手性识别作用。结果表明,匹多莫德对映体异构体的分离过程是一个焓驱动的过程,SR-异构体与手性固定相的识别作用大于RS。 三、以匹多莫德其中一个异构体(4R, 2’R) – PDMD为模板分子进行原位热聚合反应制成分子印迹毛细管整体柱。研究结果表明,以甲基丙烯酸(MAA)和丙烯酰胺(AA)为功能单体,二甲基丙烯酸乙二醇酯(EDMA)为交联剂,(4R, 2’R) – PDMD与功能单体,甲醇-十二醇为致孔剂制备的分子印迹聚合物的渗透性与选择性最好,对极性模板分子(4R, 2’R) – PDMD有较高的手性识别能力。
作品专业信息
撰写目的和基本思路
- 本项目拟采用手性HPLC法藉手性固定相、毛细管电泳手性流动相添加法对匹多莫德对映异构体进行拆分;并以匹多莫德其中一个异构体为模板分子建立合适的原位热聚合分子印迹整体柱,以实现快速手性分离;另外结合计算机辅助药物设计和手性拆分过程的热力学研究,揭示匹多莫德对映异构体拆分原理,以提高匹多莫德原料药的质量标准,进而有效地控制本品的内在质量。
科学性、先进性及独特之处
- 建立了匹多莫德对映异构体分离分析的手性固定相HPLC法,在匹多莫德原来质量标准中增订了异构体检查项目,可以有效地控制本品的内在质量,为用药安全、有效夯实基础。 从热力学角度、分子对接法研究匹多莫德手性固定相拆分机理,为手性药物的拆分、推广与应用提供理论基础研究。 籍毛细管分子印迹整体柱技术对手性药物进行拆分,为小分子对映异构体的拆分提供了一条新途径。
应用价值和现实意义
- 匹多莫德结构中有两个手性中心,其药物是以(4R, 2’S) - PDMD构型上市,在合成过程中可能会引入其光学异构体(4S, 2’R) – PDMD。因此建立该手性药物对映异构体的分离与分析方法,并从热力学角度与分子对接法研究其拆分机理,在基础理论研究及推广及应用均有十分重要的意义和价值。
学术论文摘要
- 建立匹多莫德光学异构体检查的手性固定相HPLC法,为本品的质量控制提供有效的分析方法。色谱条件为CHIRALPAK® IA柱 (250 mm×4.6 mm, 5 μm),流动相为甲基叔丁基醚-乙腈-三氟乙酸(35:65:0.2),柱温25 ℃,流速为1.0 mL/min,检测波长为210 nm。在建立的色谱条件下,匹多莫德与其对映异构体可完全分离。热力学与分子对接法研究结果表明:(4R, 2’S) - PDMD与(4S, 2’R) – PDMD异构体的分离是一焓驱动过程,SR-构型与手性固定相的识别作用大于RS。又以(4R, 2’R) – PDMD为模板分子,通过原位热聚合方式合成分子印迹毛细管整体柱,并采用毛细管电色谱的方式拆分了(4S, 2’S) – PDMD和(4R, 2’R) – PDMD,通过对制备条件的优化,其可在6min内完成分离。
获奖情况
- 本研究工作的部分内容已整理成学术论文即《手性固定相HPLC法分离测定匹多莫德对映异构体》,并已被《中国药科大学学报》录用。
鉴定结果
- 该研究中的部分内容已整理成论文,即《手性固定相HPLC法分离测定匹多莫德对映异构体》已被《中国药科大学学报》录用,并将在该杂志的第三期刊登出来。
参考文献
- [1]C. Giagulli, M. Noerder, M. Avolio, P. D. Becker, S. Fiorentini, C. A. Guzman, A. Caruso. [J]. International Immunopharmacology. 2009: 1366-1373. [2]姚彤炜. 手性药物分析 [M]. 北京: 人民卫生出版社, 2008, 84. [3]Z. Y. Wang, Z. M. Tang, Z. H. Gu, Z. D. Hu, S. M. Ma, J. W. Kang. [J]. Electrophoresis, 2005, 26, 1001-1006. [4]R. Kuhn, F. Erni. T. Bereuter, Haeusler. [J]. Anal. Chem., 1992, 64, 2815-2820. [5]A. Berthod. [J]. CHIRALITY, 2009,21, 167-175. [6]C. S. Robb. [J]. Journal of Liquid Chromatography & Related Technologies, 2007, 30, 729-759. [7]Y. François, A. Varenne, E. Juillerat, D. Villemin, P. Gareil. [J]. Journal of Chromatography A, 2007, 2, 134-141. [8]M. Li, X. C. Lin, Z.H. Xie. [J]. Journal of Chromatography A, 2009, 1216, 5320–5326. [9]李振莹, 段宏泉, 黄艳萍, 刘照胜. 分子印迹液相色谱整体柱 [J]. 化学进展, 2008, 20(5): 747-753. [10]黄晓东. 分子印迹整体柱的制备及应用研究 [D]. 大连: 中国科学院大连化学物理研究所, 2003.
同类课题研究水平概述
- 1、手性固定相的种类和应用 目前,研究和使用的CSP从结构上可以分为以下6大类:(1) 聚合物(polymer)CSP,包括天然的多糖(纤维素、淀粉等)和合成的手性聚合物;(2) Prikle型CSP,又称刷型(brush type)CSP;(3) 大环(macrocyclic)CSP,包括环糊精、冠醚和大环抗生素;(4) 蛋白质(protein)CSP;(5) 配体交换(ligand exchange)CSP;(6) 分子印迹(molecular imprinting)CSP等。Okamoto Y等曾研究采用3,5-二甲基苯基氨基甲酸酯为CSP,对510种旋光物质进行了拆分。 2 毛细管电泳手性添加法 用于毛细管手性拆分的添加剂主要有以下几类:环糊精及其衍生物、手性冠醚、大环抗生素类、多糖类、手性配体交换复合物类、手性离子液体等。T´ımea Iványi等使用手性冠醚在毛细管电泳法中做为手性选择改进剂拆分五种氨基酸。 3 毛细管分子印迹柱的制备与合成 整体柱(monolithic column)又称整体固定相、连续床或连续棒。它是由单体、引发剂和致孔剂等混合物通过原位聚合方法制备成的一个棒状整体。整体柱与常规填充柱相比具有更好的多孔性和渗透性,由于整体柱具有制备简单、内部结构均匀、柱效较高和分离速度快等优点,因此应用广泛。毛细管电色谱整体柱是毛细管电色谱研究中的一种新技术,在毛细管内壁以共价键键合大孔填料,避免了开管柱柱容量低,填充柱容易在塞子处产生气泡等缺点。 分子印迹技术(molecular imprinting technique)是指为获得在空间结构和结合位点上与某一分子(模板分子)完全匹配的聚合物的实验制备技术。其原理是在模板分子和功能单体的混合物中加入交联剂,使功能单体以共价键或非共价键的形式与印迹分子充分结合后引发聚合反应,生成分子印迹聚合物(molecularly imprinted polymers, MIP)。当模板分子移去后,聚合物上留下的结合位点保证了MIP能在一系列结构类似的分子中,选择性地识别模板分子。与传统的分离分析介质相比,MIP的最大特点是具有高度的特异选择性。将分子印迹技术及毛细管电色谱整体柱技术相结合发挥两种技术的优势,即产生了分子印迹毛细管电色谱整体柱技术。