基本信息
- 项目名称:
- 大鼠新型挫伤型脊髓损伤模型的建立及评价
- 来源:
- 第十二届“挑战杯”省赛作品
- 小类:
- 生命科学
- 大类:
- 自然科学类学术论文
- 简介:
- 通过对经典的Allen法进行创新,采用打击并加压的方法制备新型挫伤型脊髓损伤模型,模拟临床实际损伤状态。根据不同受压时间对机体产生的损伤,应用BBB运动功能评分观察大鼠脊髓损伤后活动情况,组织学和病理学方法观察大鼠脊髓损伤后变化,免疫组织化学方法对HMGB1在脊髓损伤中的表达变化进行检测,建立稳定的、理想的脊髓损伤动物模型。
- 详细介绍:
- 本实验对于经典的Allen法建模创新,采用改良Allen法并实行加压的方法制备新型挫伤型脊髓损伤模型,对照组采用改良的Allen法制备急性脊髓挫伤模型,实验组在打击的基础上分别受压3s、5s、10 s,制备新型挫伤型脊髓损伤模型;各组分别于术后1、3、7、14、21 d观察其行为学评分和病理学改变;免疫组织化学方法检测促炎因子高迁移率族蛋白B1 (HMGB1)在各组不同时间点的表达变化。制备客观稳定、适用临床研究的模型,为脊髓损伤发生的机制和及时有效的临床治疗措施奠定基础。
作品专业信息
撰写目的和基本思路
- 目的:对Allen法创新,制备新型SCI模型,通过行为学评分和形态学方法进行评价。思路:传统重物打击模型仅模拟了最初打击损伤状态,而忽略了人类SCI脊柱骨折的持续挤压作用。本实验对Allen法创新,制备新型SCI模型,对照组为急性SCI模型,实验组打击并分别受压3s、5s、10s;各组分别于术后1、3、7、14、21 d观察其行为学评分和病理学改变;检测HMGB1在各组不同时间点的表达变化。
科学性、先进性及独特之处
- 本实验通过对经典的Allen法进行创新,采用打击并实行加压的方法制备新型挫伤型脊髓损伤模型,模拟临床实际损伤状态。根据不同受压时间对机体产生的损伤,应用BBB运动功能评分观察大鼠脊髓损伤后活动情况,HE染色、甲苯胺兰染色法观察大鼠脊髓损伤后组织学变化,免疫组织化学方法对HMGB1在脊髓损伤中的表达变化进行检测,分析在脊髓损伤不同时期的变化规律,建立稳定的、理想的脊髓损伤动物模型。
应用价值和现实意义
- 脊髓损伤是一种致残率很高的疾病,患者呈逐年上升趋势。脊髓损伤后的病理生理机制非常复杂,由于不能依靠临床开展系统的研究,因而建立理想的动物模型是实验研究的基本前提,目前挫伤型脊髓损伤模型接近人类脊髓损伤的病理生理特点及变化规律,但忽略了持续性的挤压作用。 本实验创新新型SCI模型,充分模拟临床实际损伤状态,推动SCI研究的不断深入,为SCI患者功能障碍减轻,生活质量改善提供帮助。
学术论文摘要
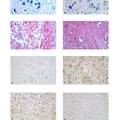
- 目的:制备新型挫伤型脊髓损伤大鼠模型,通过行为学评分和形态学方法进行评价,为进一步研究脊髓损伤的机制及早期治疗提供依据。方法:SD大鼠随机分为对照组和实验组,对照组(A组)采用改良的Allen法制备急性脊髓挫伤模型,实验组在打击的基础上分别受压3s(B组)、5s(C组)和10s(D组),制备新型挫伤型脊髓损伤模型;各组分别于术后1、3、7、14、21 d观察其行为学评分和病理学改变;免疫组织化学方法检测促炎因子高迁移率族蛋白B1 (HMGB1)在各组不同时间点的表达变化。结果:实验组各时间点BBB评分和损伤程度与对照组比较均有显著差异(P<0. 05),其中A组和B组术后损伤程度差别微小; C组后肢运动功能障碍明显,脊髓损伤区域出现典型的病理改变;D组损伤最严重,死亡率高。HMGB1表达以损伤C组为典型代表,术后阳性表达明显增多,第3d达高峰,主要表达部位为神经元胞浆和神经胶质细胞核内。结论:采用改良Allen法打击再受压5 s制备的脊髓损伤模型能很好地模拟临床实际,且稳定性高、可复制性好,为一种新型挫伤型脊髓损伤模型。
获奖情况
- 论文《实验性脊髓损伤模型的研究进展》发表于解剖科学进展2009,15(2):253—256 论文《大鼠新型挫伤型脊髓损伤模型的建立及评价发表于》神经解剖学杂志2010,26(6):638-642 论文《人脐血MSCs移植修复大鼠脊髓损伤的效果及机制》已被中国临床解剖学杂志接受,待发
鉴定结果
- 此模型充分模拟临床实际损伤状态,稳定性强,可靠性高,推动了SCI研究的不断深入,为脊髓损伤的临床研究提供了很好应用前景。
参考文献
- [1] Narazaki DK, Barros Filho TE, Oliveira CR,et al. Spinal cord regeneration: the action of neurotrophin-3 in spinal cord injury in rats [J]. Clinics, 2006, 61: 453-460. [2] Sedy J,Urdzikova L,Jendelova P,et al.Methods for behavioral testing of spinal cord injured rats[J].Neuroscience and Biobehavioral Reviews,2008,32:550–580. [3] 陈昱,练克俭.继发性脊髓损伤中细胞凋亡的基因调控[J].中国现代医生,2008,46:33-35. [4]胥少汀.脊髓原发和继发损伤[J].中华骨科杂志,2005,25:575-576. [5] Rendon-Mitchell B,Ochani M,Li J,et al.FN-gamma induces high mobility group box 1 protein release partlythrough a TNF-dependent mechanism[J].Immunol,2003,170:3890-3897. [6] 孙为增,王新家.脊髓损伤后细胞因子的变化及作用[J].实用医学杂志,2009,25:1337-1338. [7] Gardella S,Andrei C,Ferrera D,et al.The nuclear protein HMGB1 is secreted by monocytes via a non-classical,vesicle-mediated secretory pathway[J].EMBO Rep,2002,3:995 - 1001. [8] Scaffidi P,Misteli T,Bianchi ME.Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J].Nature,2002,418:191-195.
同类课题研究水平概述
- 脊髓损伤(spinal cord injury,SCI)是一种致残率很高的疾病。随着交通业和建筑业的迅速发展,SCI患者呈逐年上升趋势,是脊柱外科和神经科学领域关注的热点和难点。由于脊髓是许多神经功能的中介通路,SCI及其继发性病理生理反应可直接导致神经功能损伤,从而引起组织、器官功能障碍。脊髓损伤后的病理生理机制非常复杂,研究SCI的组织病理学、细胞和组织化学以及电生理变化,对于阐明SCI的自然病程和探索新的治疗方法有极为重要的指导意义。由于不能依靠临床开展系统的研究,因而建立理想的动物模型是实验研究的基本前提。脊髓损伤研究已趋向于科学性、先进性、创新性,对动物模型的建立将提出更高、更新、更切实际的要求。压迫型脊髓损伤模型为非瞬间损伤,便于进行神经功能和代谢改变的检测;锐性脊髓损伤模型适于进行再生性实验研究,但与临床之间相关性差;脊髓缺血及再灌注损伤模型尚不能满足临床治疗的需要。动物模型都有其优缺点,完全理想化的模型是不存在的,在今后相当长一段时间内,进一步研究和完善SCI模型,加深对其机制的理解,推动SCI研究的不断深入,最终使脊髓损伤后功能重建成为现实,使SCI患者功能障碍减轻,生活质量改善。 本研究对于经典的Allen法建模创新,采用打击并压迫的方法充分模拟临床实际,观察组织损伤信号HMGB1的表达规律符合损伤的病理变化特点,研究出一种通用的、具备稳定性好、可复制性强、存活率高的SCI动物模型,将为脊髓损伤发生的机制和及时有效的临床治疗措施奠定实验基础。